研究内容
プレシジョンがん医療
プレシジョンがん医療は、ゲノム情報をはじめとした様々なデータに基づいて、患者さんに最も適したがんの予防法、治療法を提供する医療です。
近年のがん遺伝子解析により、がん難治性の背景には、細胞および個体レベルでの遺伝子異常があることが明らかとなってきました。細胞レベルでの難治性を規定する遺伝子異常として、がん抑制遺伝子TP53の機能欠失型変異が代表的です。一方で、個体レベルでの難治性を規定する要因として、患者個体内でのがんクローンの多様性(clonal heterogeneity)があります。患者さんの体内にあるがんは、細胞ごとに遺伝子変異やエピジェネティックなDNAレベルの変化だけでなく、RNA、タンパク発現レベルでの多様性をもつがん細胞の集団です。従って、がんの根治には、細胞・個体レベルの難治性をともに打破する治療が必要です。また、手ごわい難治性をがんが獲得する前に治療・予防することも重要です。プレシジョンがん医療は、ゲノム情報をはじめとした様々なデータに基づいて、患者さんに最も適したがんの予防法、治療法を提供する医療です。
患者さんのがん組織におけるゲノム異常を把握することは、敵(がん)を知るうえでの第一歩です。造血器腫瘍(血液がん)の場合は、がんゲノム情報が分子標的療法の適応を決めるだけでなく、造血幹細胞移植の適応、病型診断、予後予測に必要です。がん組織のゲノム異常を効率的に解析する検査法として、がん遺伝子パネル検査があります。ヒトの遺伝子は約2万種類ありますが、がん遺伝子パネル検査では、がんに関連した200-500の遺伝子を網羅的に解析し、がん組織における遺伝子異常を同定可能です。本邦では固形がん分野で、2種類の遺伝子パネル検査が2019年6月に保険償還され、臨床の場で使用されていますが、血液がんに特化した遺伝子パネル検査は存在しません。固形がんと血液がんでは、変異が起こる遺伝子の種類が異なるだけでなく、パネル検査の用途も異なりますので、血液がんに特化したパネル検査が必要です。私達は、九州大学第一内科血液研究室、九州大学病院遺伝子・細胞療法部と連携して、血液がんに特化した遺伝子パネル検査DISCAVar(Diagnostic Sequencing of Cancer Associated Variants)を開発し、九州大学病院及び関連施設におけるプレシジョンがん医療の研究を行っています。また、DISCAVarパネルは九州大学第一内科血液研究室が参加している各種の臨床研究の付随研究に活用されています。
遺伝子パネル検査 DISCAVar
(Diagnostic Sequencing of Cancer Associated Variants)
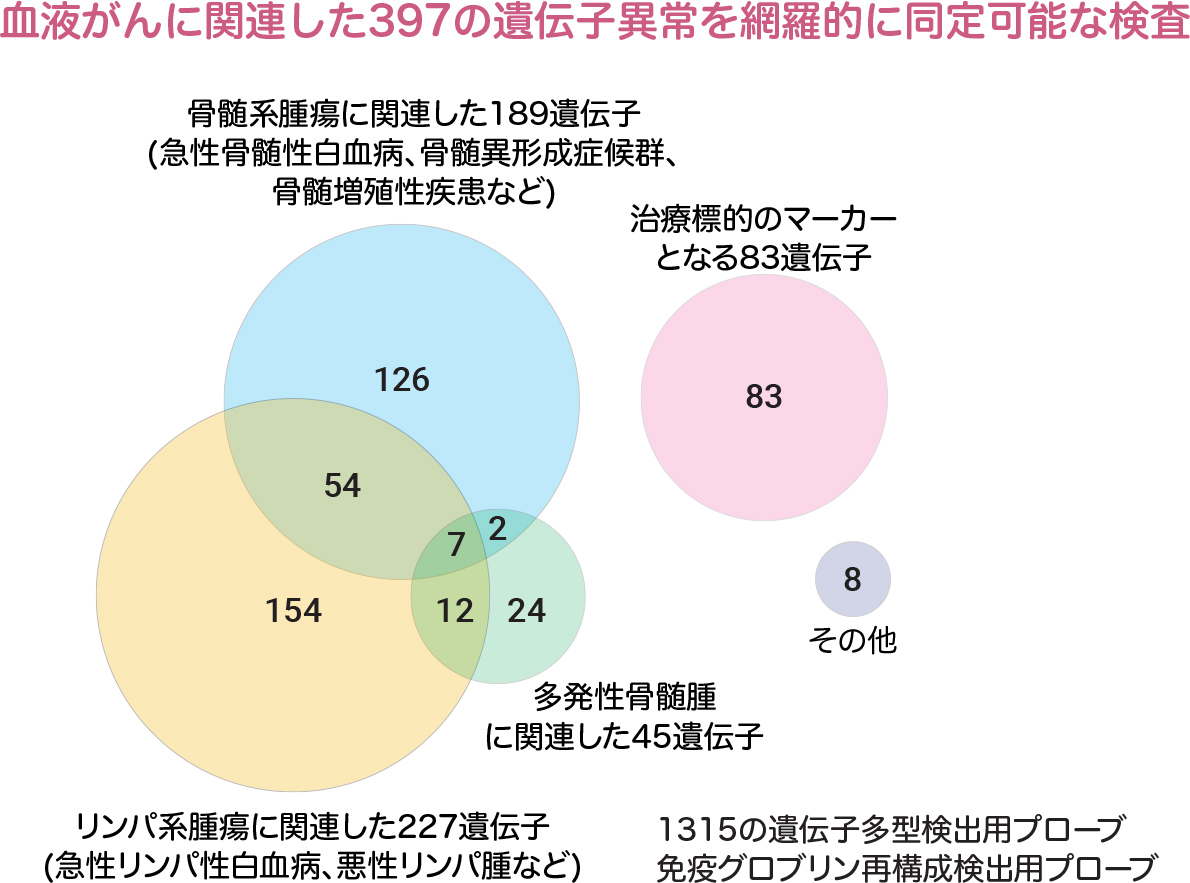
Figure 1 DISCAVarパネルは、九州大学第一内科、九州大学病院遺伝子・細胞療法部との共同研究で開発された、造血器腫瘍に特化した遺伝子パネル検査である。骨髄系腫瘍に関連した189遺伝子、リンパ系腫瘍に関連した227遺伝子、多発性骨髄腫に関連した45遺伝子の他に、薬剤標的となる可能性のある遺伝子など、計397遺伝子のすべてのエクソンを網羅的に解析可能である。また、コピー数解析やサンプル間のコンタミネーションの発見を可能にするSNPプローブや、薬剤感受性に関わるSNPを標的にしたプローブ、さらにIgH再構成を同定するためのプローブも搭載されている。 Semba et al. unpublished.
DISCAVar レポートの例
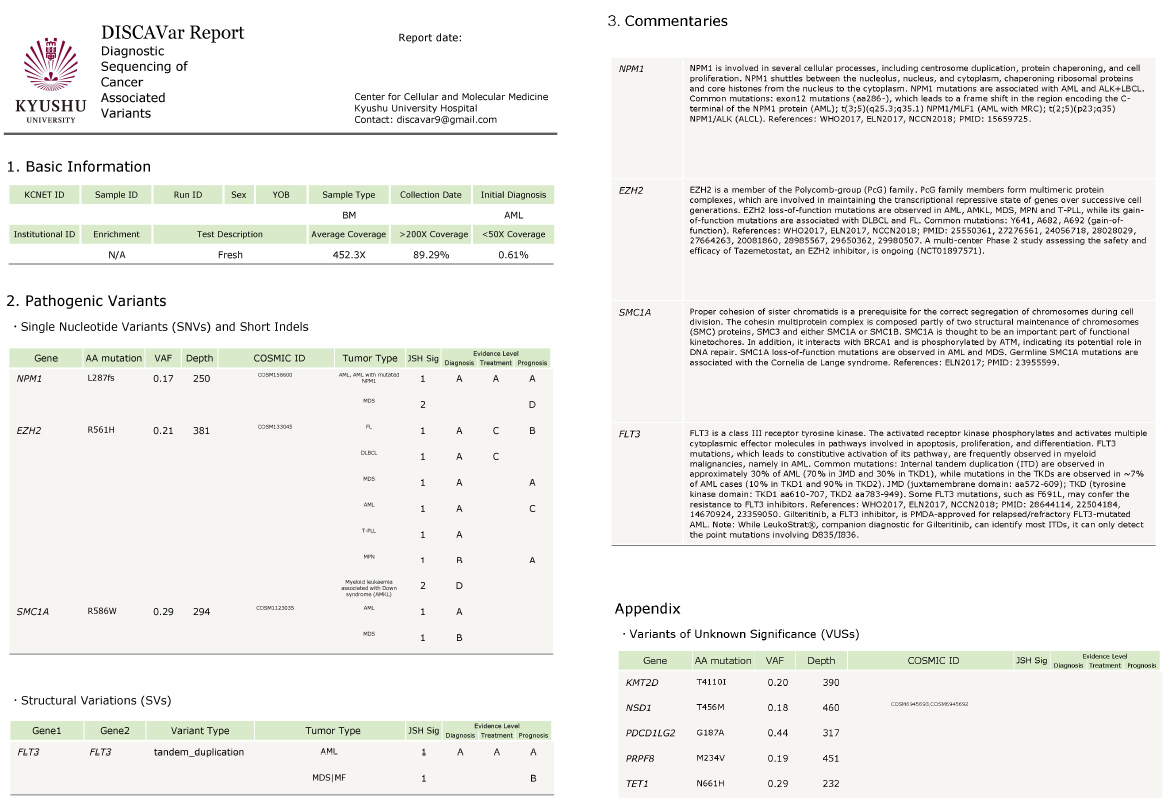
Figure 2 DISCAVarパネル検査のレポート例。検査の基本情報 (Run ID、Average coverageなど)に加えて、同定された病的変異 (pathogenic variants)と、各変異のVAF (variant allele frequency)、各遺伝子異常の臨床的意義とエビデンスレベルを日本血液学会 (JSH) の「造血器腫瘍ゲノム検査ガイドライン」に基づいて提示している。さらに、各遺伝子に関する説明と関連する参考文献に関する情報や、病的意義の明らかではない変異 (VUS: variants of unknown significance)に関しても記載している。Semba et al. unpublished.
2020年12月現在、本邦には保険適用のある血液がんに特化した遺伝子パネル検査は存在しません。血液がん臨床における、プレシジョン医療を実現するためにも、研究目的ではなく、実臨床に使用できるパネル検査の開発が必要です。現在私達は、九州大学第一内科、国立がん研究センター、京都大学、岡山大学、名古屋医療センター、名古屋市立大学、国立成育医療研究センター、筑波大学、大塚製薬株式会社と共同で、保険償還を目指した国内初の血液がん遺伝子パネル検査を開発しています。
遺伝子パネル検査は、患者さんのがんを理解するうえで重要ですが、患者さんのがんの一端を理解することに過ぎず、あくまでがん克服の第一歩です。当分野では、細胞・個体両レベルでのがん難治性を克服するためのプレシジョンがん医療を、臨床・研究の両側面から追求していきます。
機能的がんジェノミックス
「機能的がんジェノミックス」は、CRISPR/Cas9遺伝子編集技術などを駆使して、がんの治療標的を網羅的に同定する手法です。
近年のがんゲノム解析の進歩により、がん発症・進展・維持に関わる多くの遺伝子異常が判明し、がんゲノムはほぼ解明されたといっても過言ではないかもしれません。これからは個々のがん細胞の遺伝子背景を踏まえたうえで、新しい治療標的の同定、治療法(薬剤の併用療法、免疫療法など)の開発、薬剤耐性のメカニズムの同定が必要になります。
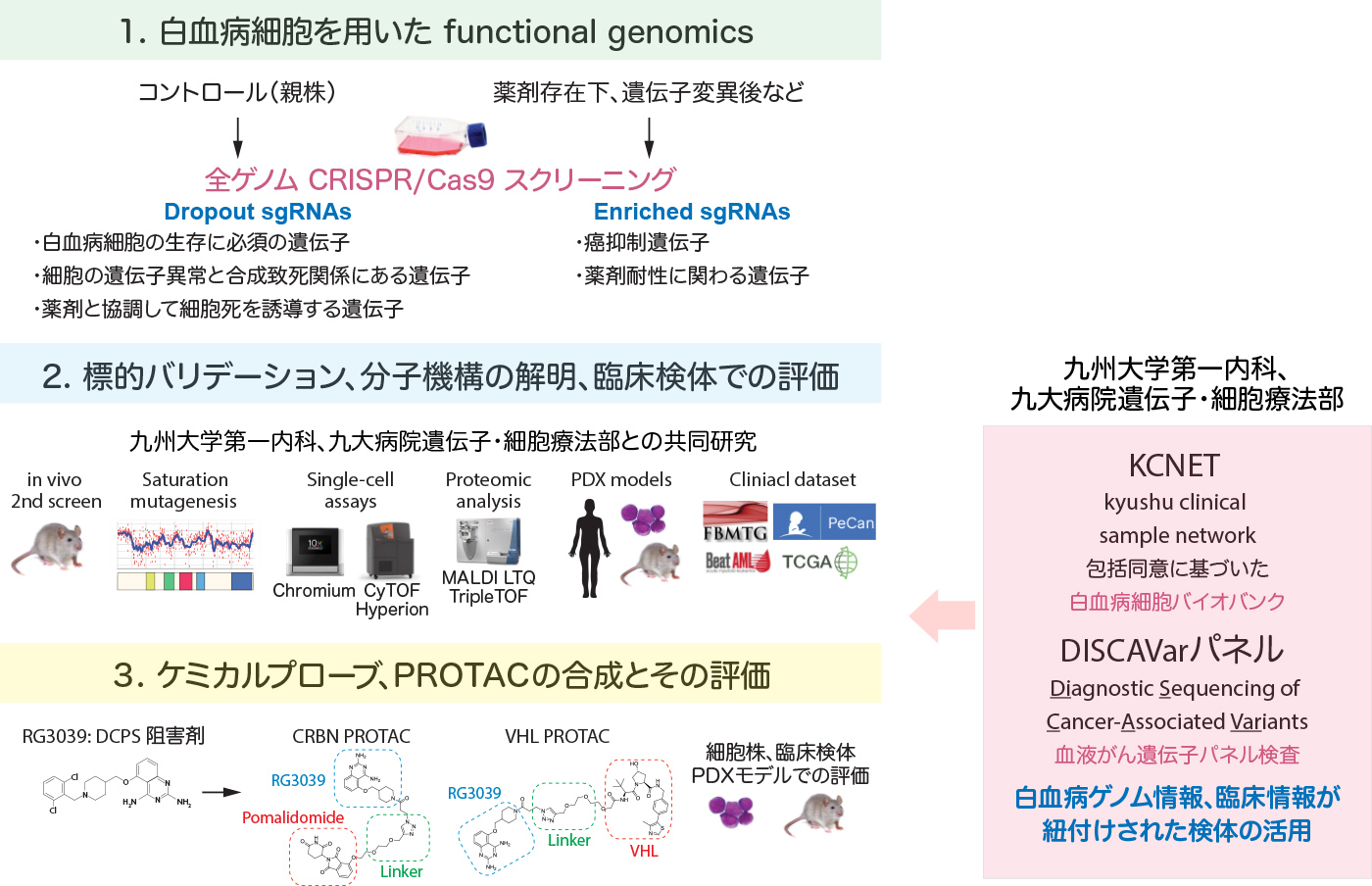
私達は、CRISPR/Cas9 遺伝子編集技術を用いて、タンパクをコードする全遺伝子を標的とした、がん細胞の表現型(フェノタイプ:増殖、細胞死、分化など)に基づく「機能的がんジェノミックス」研究を展開しています。遺伝子背景の異なる白血病細胞株、様々な薬剤存在下での全ゲノムスクリーニングを行うことで、難治性の白血病に対する新規治療法、治療薬の開発を行っています。
新たな白血病治療標的の同定:
タンパクをコードする全遺伝子を標的としたCRISPR/Cas9スクリーニング
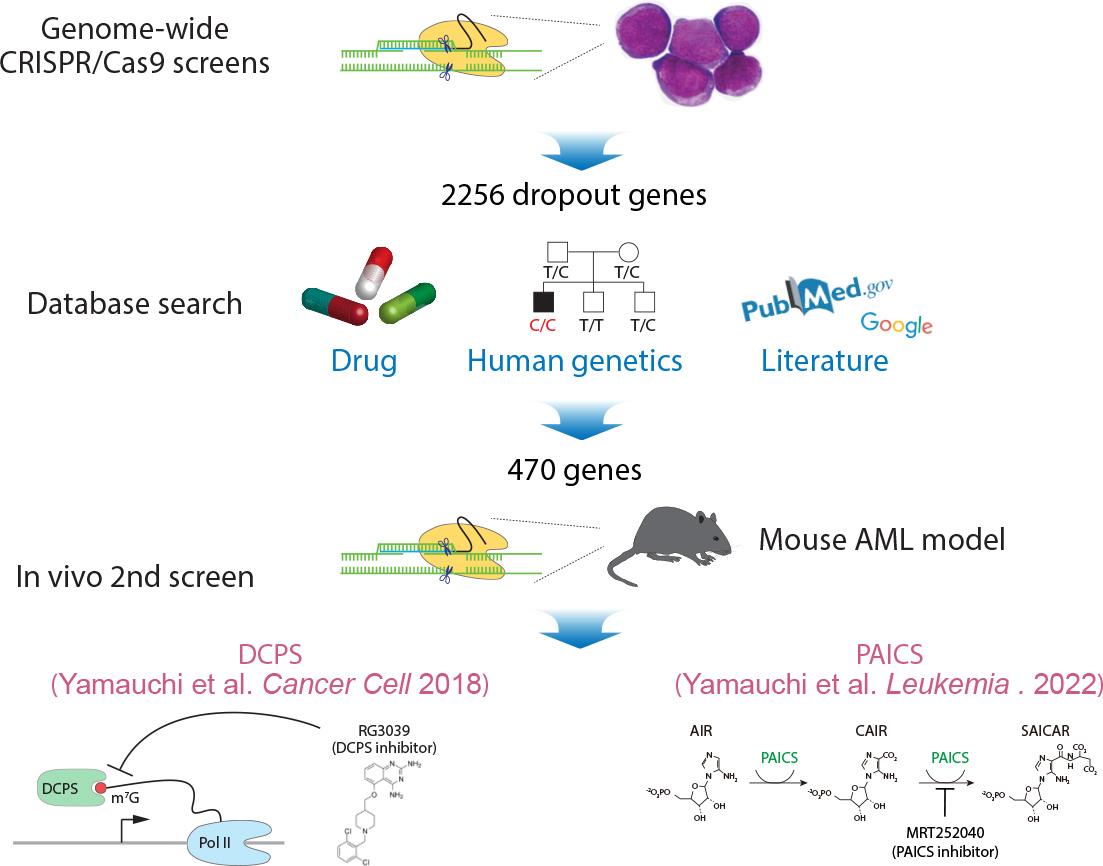
Figure 3 タンパクをコードする全遺伝子を標的としたCRISPR/Cas9のスクリーニングの概要。遺伝子変異が少ない白血病細胞株を作製するため、MLL/AF9やCALM/AF10などのがん遺伝子をマウス造血幹細胞に導入し、マウスで急性骨髄性白血病 (AML) を発症させ、Cas9を恒常的に発現するAML細胞株を樹立したうえで、スクリーニングを行った。一次スクリーニングより約2000の治療標的候補遺伝子を同定し、薬剤・ヒトゲノム・文献のデータベース検索より、470の遺伝子を抽出した。さらに、470遺伝子を標的とした独立したsgRNA libraryを作製し、in vivoでCRISPR/Cas9スクリーニングを行い、DCPS、PAICSといった新規のAML治療標的分子を同定した。 Yamauchi et al. Cancer Cell 2018. Yamauchi et al. Leukemia . 2022
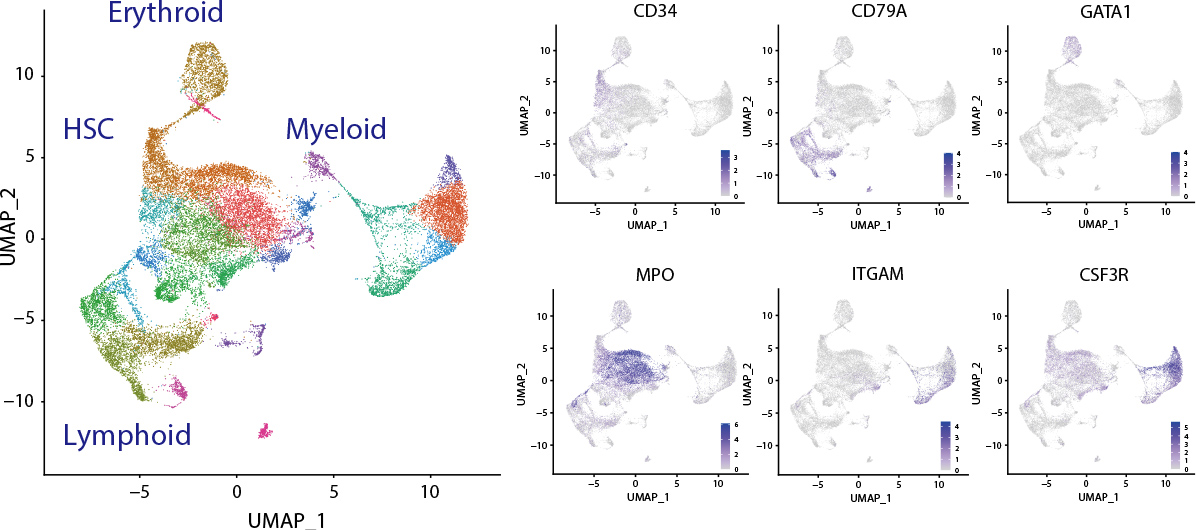
がんの1細胞研究
「がんの1細胞研究」により、がんの全体像や病態がより詳細に解明され、がんのプレシジョン医療につながります。
がんが難治性である大きな要因として、患者個体内でがんクローンの多様性(clonal heterogeneity)が挙げられます。患者さんの体内にあるがんは、細胞ごとに遺伝子変異やエピジェネティックなDNAレベルの変化だけでなく、RNA、タンパク発現レベルでの多様性をもつがん細胞の集団です。従って、患者さんのがんをより深く理解するためには、がん細胞やその周囲にある正常細胞一つ一つの特性(遺伝子変異、mRNA、タンパク発現など)を正確に把握する必要があります。当分野では、より詳細にがんの全体像を把握するために、様々な1細胞解析法(single-cell analysis)を活用しています。
造血器腫瘍の臨床においては、造血幹細胞移植が根治を望める重要な治療法の一つです。白血病に対して造血幹細胞移植を行った患者さんの体内では、ドナー由来の細胞とレシピエント(患者)由来の細胞・組織が、相互に関係して移植片対宿主病(GVHD: graft versus host disease)を引き起こしたり、移植片対白血病(GVL: graft versus leukemia)効果を誘導したりします。私達は、九州大学第一内科、九州大学遺伝子・細胞療法部と共同で、1細胞レベルで造血幹細胞移植後の免疫構築、白血病再発のメカニズムの解明を試みています。
プレシジョン血液学
「プレシジョン血液学」は、血液細胞の分化・増殖を制御する分子機構を解明し、血液がんをはじめとした血液疾患、膠原病、慢性炎症性疾患、循環器系疾患のプレシジョン医療につなげる学問です。
血液細胞は、大きく分けて白血球、赤血球、血小板に分類されます。白血球はさらに、骨髄球系、リンパ球系に大別され、免疫担当細胞として機能しています。多種・多機能にわたる血液細胞ですが、すべて一つの造血幹細胞(HSC:hematopoietic stem cell)から派生すると考えられています。造血幹細胞から、体内の血液細胞が産生される現象を造血(hematopoiesis)とよび、造血は、造血幹細胞の自己複製(self-renewal)と分化(differentiation)、造血前駆細胞(造血幹細胞が分化した未成熟細胞)の分化と増殖(proliferation)によって成り立っています。造血器腫瘍(血液がん)は、正常造血過程のどこかで細胞に遺伝子異常が起こり、分化と増殖のバランスに異常が生じた結果と考えられています。従って、造血器腫瘍を理解するうえで、正常造血、血液細胞の発生を制御している分子機構を正しく理解することが非常に重要です。私達が考える「プレシジョン血液学」は、このような分子機構を解明し、造血器腫瘍のみならず、他の血液疾患や、血液・免疫細胞が関わる膠原病、慢性炎症性疾患、循環器系疾患の治療につなげる学問です。
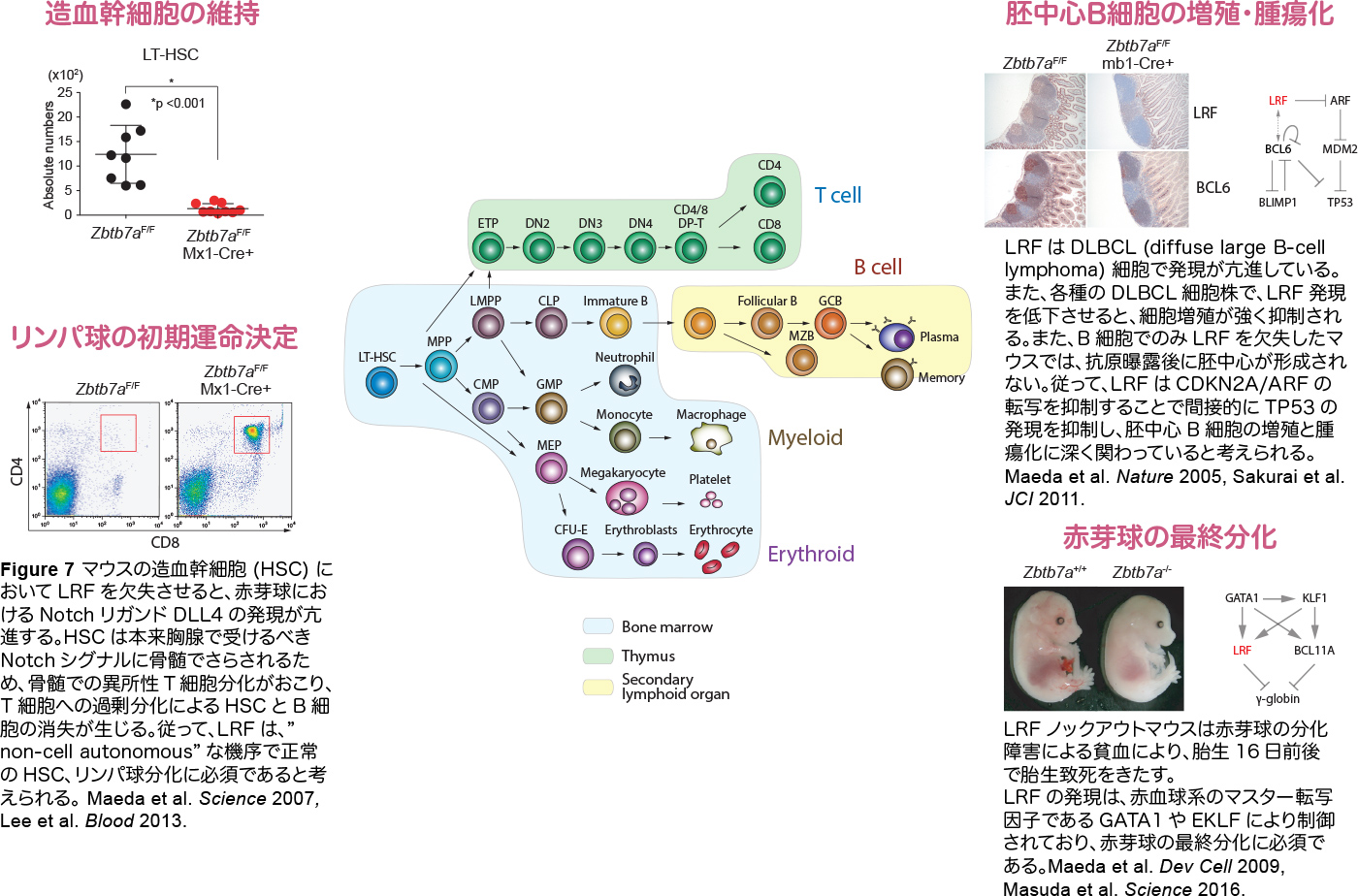
造血幹細胞 (HSC) はすべての血液細胞を産生する
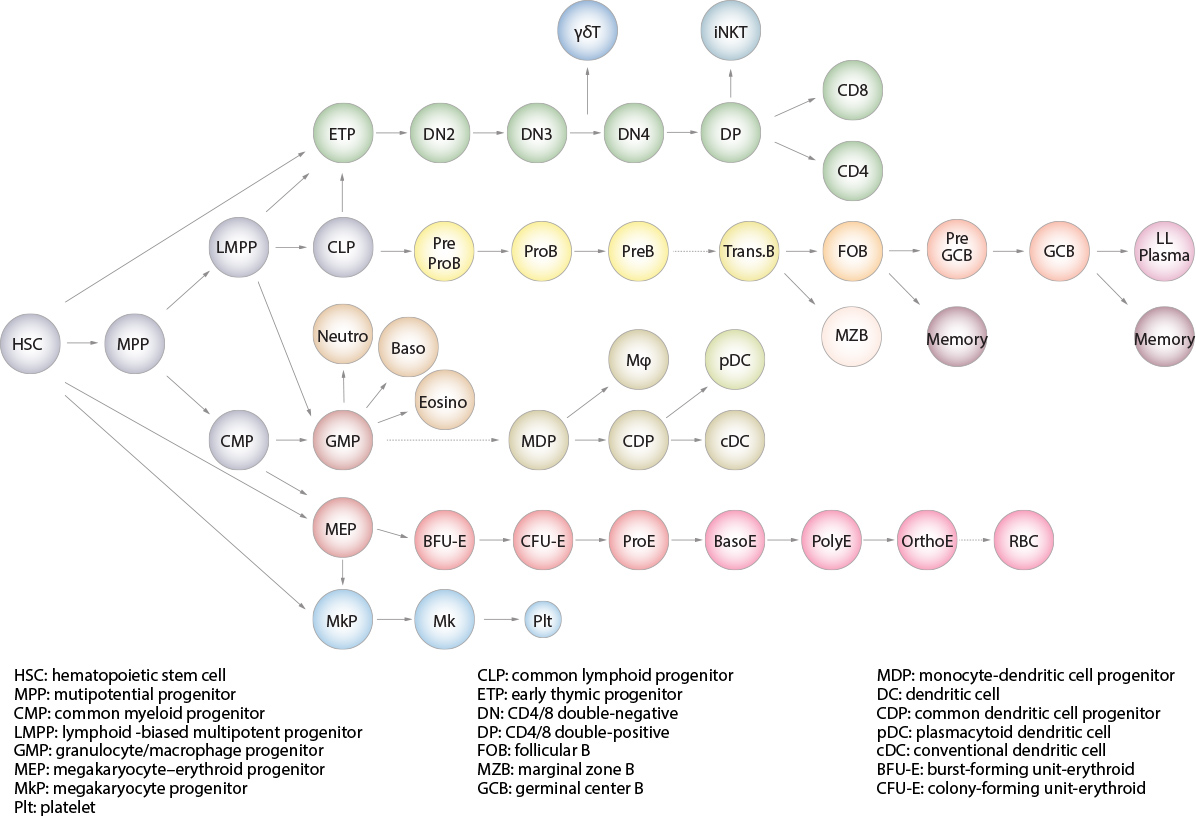
Figure 6 造血幹細胞(HSC)は自己複製と分化により、すべての血液細胞を産生し、造血・免疫系を維持していると考えられている。この図では、マウスにおける造血細胞の分化系統を図示している。
造血細胞の分化、グロビン遺伝子発現調節に重要な転写因子LRFについて
私達は、転写因子 LRF(Leukemia Lymphoma related Factor)/ZBTB7A の血液がん及び正常造血における機能を明らかにしてきました。LRFは濾胞性大細胞型リンパ腫細胞に高発現していること、マウスのリンパ球系幼若細胞に強制発現することで、急性リンパ性白血病を発症することなどから、がん遺伝子としての働きがあることを見出しました(Maeda et al. Nature, 2005)。さらに、各種のLRFのコンディショナルノックアウトマウスの解析から、LRFが骨髄におけるB・Tリンパ球の運命決定(Maeda et al. Science 2007)、造血幹細胞の維持(Lee et al. Blood 2013)、2次リンパ組織における胚中心形成(Sakurai et al. JCI 2011)、赤芽球の最終分化(Maeda et al. Dev Cell 2009)に必須であることを報告してきました。
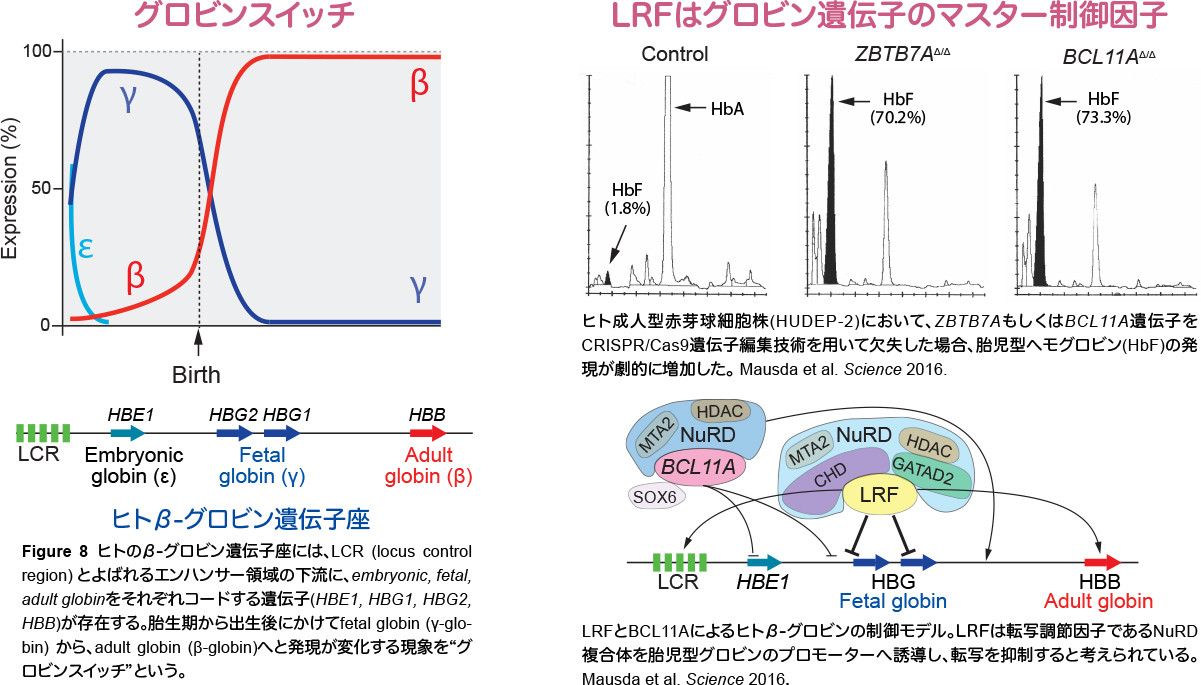
LRFの赤芽球分化における分子機構を探索する過程で、LRFが胎児型β-グロビン(γ-globin)から成人型β-グロビン(β-globin)への発現移行(グロビンスイッチ)を調節するマスター転写因子であることを発見しました(Maeda et al. Nature, 2005, Masuda et al. Science 2016)。遺伝性鎌状赤血球症(SCD: sickle cell disease)やβサラセミアは、成人型β-グロビン遺伝子の変異により発症する遺伝性の病気です。特にSCDは、マラリア感染の多いアフリカやインドに多くみられる致死的な疾患であり、向後40年間で世界的に1400万人が罹患するといわれています。SCDの患者体内では、β-globin遺伝子の1塩基置換によりアミノ酸置換が起こることで、グロビン分子が異常な多量体を形成するため、赤血球が鎌状(三日月状)の形体を呈します。この形体変化により、本来可塑性に富む赤血球が、その可塑性を失い、毛細血管内で塞栓を形成しやすくなるため、発作性の疼痛を伴う急性胸部症候群(acute chest syndrome)をはじめとした全身の臓器虚血や、重症感染症をきたします。アフリカ諸国におけるSCD患者の平均寿命は正確にはわかりませんが、米国では40-50歳といわれています(米国の平均寿命は2017年で78.5歳です)。現在、造血幹細胞移植のみが、治癒が期待できる唯一の治療法です。新しい治療法としてCRISPR/Cas9遺伝子編集技術を用いた遺伝子治療が期待されていますが、発展途上国に多くみられる疾患であり、予防医学的なアプローチに加えて、多くの患者さんに投与可能な薬剤の開発が期待されています。SCDの治療法として、出生後早期に発現が抑制される胎児型βグロビンを再活性化することが、症状の軽減につながることが知られています。成人マウスでLRF遺伝子を欠失させると、成人型βグロビンの発現が抑制され胎児型βグロビンの発現が亢進すること、ヒト赤芽球細胞株およびヒト臍帯血由来赤芽球においてLRF発現を抑制すると、胎児型βグロビンの発現が亢進することから、LRFがSCD治療の標的となる可能性があると考えています。
クラサリンアダプタータンパクPICALMについて
PICALM-AF10融合遺伝子は急性骨髄性白血病(AML)やT-細胞性急性リンパ性白血病(T-ALL)において、比較的稀にみられる遺伝子異常ですが、この融合遺伝子を持つ白血病の予後は極めて不良であると考えられています。私達は、PICALMの正常造血における機能を解析するために、Picalm KOマウスおよび、Picalm conditional KOマウスを作製し、造血器及び、他の臓器における機能を解析しました。Picalm KOマウス、造血器特異的Picalm conditional KOマウス(Mx1-Cre)はともに鉄欠乏性の貧血をきたし、Picalmが赤芽球表面のトランフェリンレセプター(TFR)のエンドサイトーシスに必須であることを見出しました。また、成人マウスでPicalmを全身組織で欠失させたところ(ERT2-Cre)、鉄欠乏性貧血とともに、全身の毛が脱色したことから、Picalmが細胞内でのメラニン輸送に関与していることが示唆されました。一方で、リンパ球系、骨髄球系の細胞では、軽度のTリンパ球数の減少以外、明らかな異常は認めなかったことから、PICALM-AF10融合タンパクによる白血病化のメカニズムとして、融合タンパクによるPICALMの正常機能の阻害という側面は限定的と結論づけました。AF10(MLLT1)が関連した融合遺伝子は、MLL-AF10(KMT2A/MLLT1)など、白血病に関連した他の融合遺伝子においても認められること、PICALM-AF10患者では鉄欠乏性貧血を認めないことなどから、PICALMはAF10タンパクの機能異常を助ける足場(scaffold)のような役目があるかもしれません。
PICALMによるトランスフェリン受容体のエンドサイトーシス制御
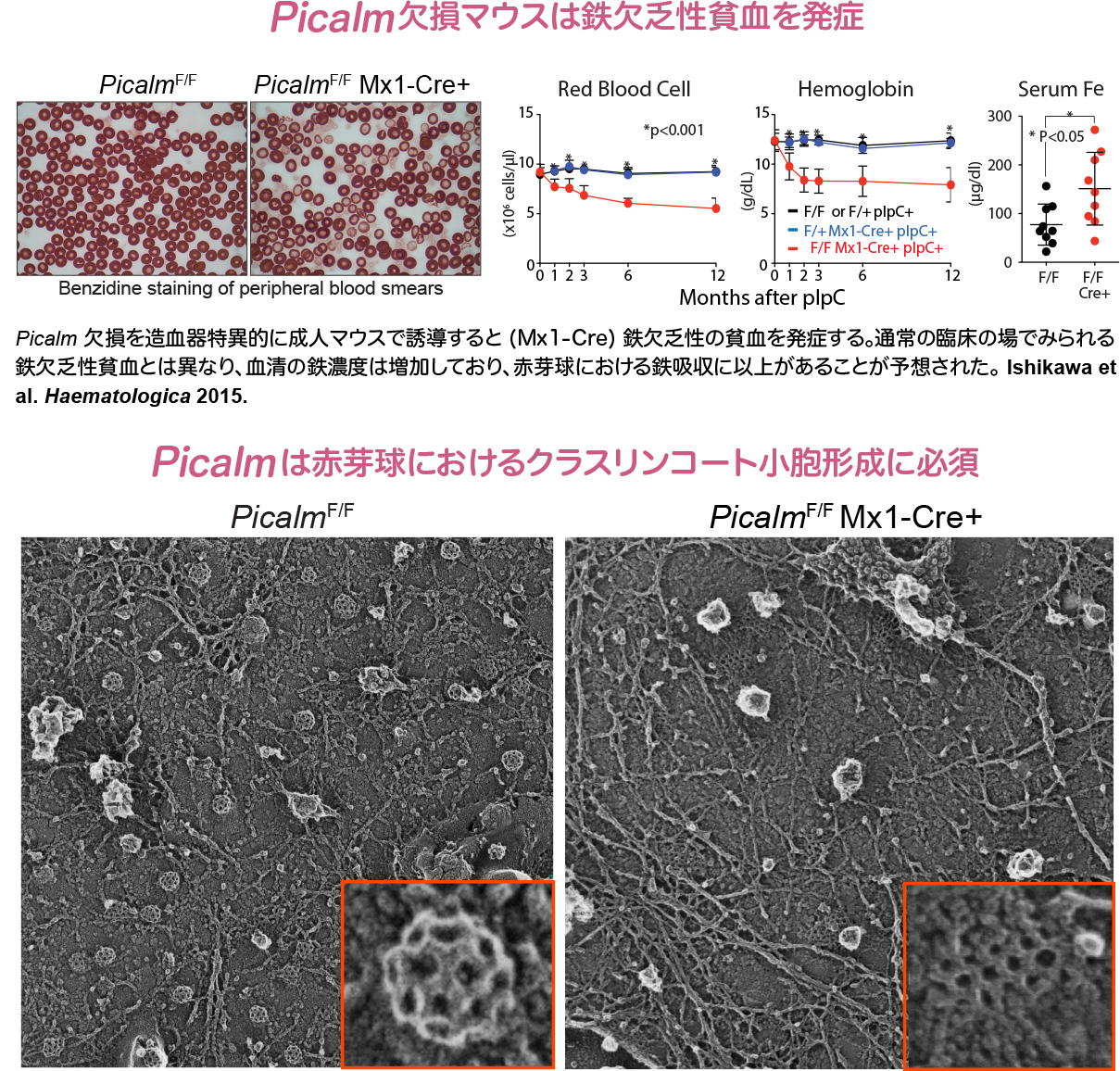

Figure 9 電子顕微鏡(freeze-etch electron microscopy)にてPicalm欠損赤芽球を観察したところ(細胞膜を細胞内から見上げた図)、正常赤芽球では格子状のクラスリンコート小胞(clathrin-coated pits)が無数に散在していたのに対し、Picalm欠損赤芽球では小胞形成をほとんど認めなかった。PICALMはトランフェリン受容体の細胞内への取り込み(エンドサイトーシス)に必要なクラスリンコート小胞形成に必須であることが判明した。Ishikawa et al.Haematologica 2015.
CHIP(Clonal Hematopoiesis of Indeterminate Potential)
「CHIP」は、血液疾患のみならず、循環器疾患、慢性炎症性疾患のプレシジョン医療につながる新しい概念です。
血液がんでみられるような遺伝子異常は、血液がん細胞にしか認められないと考えられてきましたが、ごく最近、そのような遺伝子異常が、加齢に伴い一定の頻度で認められることがわかってきました。どうして血液がんではない人に遺伝子異常を持つ血液細胞が存在するのか、その原因はまだ不明な点が多いのですが、発生の早期もしくは、加齢に伴って何らかの理由で出現した遺伝子異常をもった細胞(クローン)が長い年月を経て、増殖優位性を獲得すると考えられています。このような造血はCHIP(Clonal Hematopoiesis of Indeterminate Potential)とよばれ、CHIPを認める人はCHIPがない人に比べて、高率に一部の血液がんを発症しやすいことがわかっています。さらに、CHIPを認める人は、循環器疾患や慢性炎症性疾患のリスクが高いこともわかってきました。血液・免疫細胞はすべての臓器に存在し、全身を巡っていますから、CHIP由来の血液・免疫細胞が、がん化はしないまでも、何らかの機能異常をきたすことで、加齢に伴って認める多くの疾患の要因となっている可能性があります。私達は、CHIPから様々な循環器疾患、慢性炎症性疾患の病因を紐解き、治療法や予防法を開発することも、プレシジョン医療学分野の役目と考えています。